氨氣�,Ammonia����, NH3��,無色氣體。有強烈的刺激氣味�����。密度 0.7710���。相對密度0.5971(空氣=1.00)��。易被液化成無色的液體�。在常溫下加壓即可使其液化(臨界溫度132.4℃,臨界壓力11.2兆帕�����,即112.2大氣壓)�����。沸點-33.5℃�。也易被固化成雪狀固體。熔點-77.75℃��。溶于水����、乙醇和乙醚�����。在高溫時會分解成氮氣和氫氣���,有還原作用��。有催化劑存在時可被氧化成一氧化氮�����。用于制液氮�、氨水、硝酸�、銨鹽和胺類等?��?捎傻蜌渲苯雍铣啥频?��,能灼傷皮膚、眼睛���、呼吸器官的粘膜����,人吸入過多����,能引起肺腫脹,以至死亡 ���。
分子結(jié)構(gòu)
 氨氣
氨氣
氮原子有5個價電子����,其中有3個未成對,當它與氫原子化合時��,每個氮原子可以和3個氫原子通過極性共價鍵結(jié)合成氨分子����,氨分子里的氮原子還有一個孤對電子。
物質(zhì)性質(zhì)
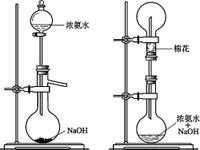
氨氣的性質(zhì):無色氣體�����,有刺激性氣味���、密度小于空氣��、極易溶于水(且快)����。常溫時��,1體積水大約溶解700體積氫��。溶于水發(fā)生以下反應(yīng)使水溶液呈堿性:NH?+H?O====NH?·H2O(NH4OH)====NH4?+OH- (可逆)可作紅色噴泉實驗���。生成的一水合氨NH?·H2O(NH4OH)是一種弱堿�����,很不穩(wěn)定�����,會分解�����,受熱更不穩(wěn)定:NH?·H2O(NH4OH)===(△) NH? ↑+H?O
濃氨水易揮發(fā)出氨氣��,有刺激難聞的氣味��。
氨氣能跟酸反應(yīng)生成銨鹽:NH?+HCl == NH4Cl (晶體)
氨是重要的化工產(chǎn)品�,氮肥工業(yè)、有機合成工業(yè)及制造硝酸�����、銨鹽和純堿都離不開它����。氨氣容易液化為液氨,液氨氣化時吸收大量的熱���,因此還可以用作制冷劑����。
銨鹽的性質(zhì):易溶于水(很多化肥都是銨鹽)����,受熱易分解,放出氨氣:
NH4Cl====NH? ↑+HCl ↑
NH4HCO?====NH3 ↑+H2O ↑+CO2 ↑
可以用于實驗室制取氨氣:(干燥銨鹽與和堿固體混合加熱)
NH4NO3+NaOH====NaNO3+H2O+NH3 ↑
2NH4Cl+Ca(OH)2====CaCl2+2H2O+2NH3 ↑
氨氣可以用向下排空氣法收集��,用紅色石蕊試紙檢驗是否收集滿�,用氫氧化鈉溶液處理尾氣。
基本性質(zhì)
物理性質(zhì)
相對分子質(zhì)量 17.031
 氨氣
氨氣
氨氣在標準狀況下的密度為0.7081g/L
氨氣極易溶于水��,溶解度1:700
臨界點:133℃����,11.3Atm
EINECS號: 231-635-3
無色有刺激性惡臭的氣體;蒸汽壓 506.62kPa(4.7℃);熔點 -77.7℃;沸點-33.5℃;溶解性:極易溶于水,相對密度(水=1)0.82(-79℃);相對密度(空氣=1)0.6;穩(wěn)定性:穩(wěn)定;危險標記 6(有毒氣體);主要用途:用作制冷劑及制取銨鹽和氮肥
|
1
|
名稱
|
氨
|
|
2
|
化學(xué)式
|
NH3
|
|
3
|
CAS 注冊號
|
7664-41-7
|
|
4
|
相對分子質(zhì)量
|
17.031
|
|
5
|
熔點
|
195.41K��,-77.74℃�����,-107.93oF
|
|
6
|
沸點����,101.325kPa(1atm)
|
239.72K,-33.43℃����,-28.17oF
|
|
7
|
臨界溫度
|
405.65K,-132.5℃����,-270.5oF
|
|
8
|
臨界壓力
|
11.3mPa,112.78bar��,111.3atm���,1635.74psia
|
|
9
|
臨界體積
|
72.47cm3/mol
|
|
10
|
臨界密度
|
0.235g/cm3
|
|
11
|
臨界壓縮系數(shù)
|
0.242
|
|
12
|
偏心因子
|
0.252
|
|
13
|
液體刻密度 ��,25℃時
|
0.602g/cm3
|
|
14
|
液體熱膨脹系數(shù) ����,25℃時
|
0.0025 1/℃
|
|
15
|
表面張力 ,25℃時
|
19.75×10-3 N/m�����,19.75dyn/cm
|
|
16
|
氣體密度 ��,101.325 kPa(atm)和70 oF(21.1℃)時
|
0.705kg/m3 ��,0.0440 lb/ft3
|
|
17
|
氣體相對密度��,101.325 kPa(1atm)和70oF時(空氣=1)
|
0.588
|
|
18
|
汽化熱 ��, 沸點下
|
1336.97kj/kg�,574.9BTU/1b
|
|
19
|
熔化熱 , 熔點下
|
332.16kj/kg���,142.83BTU/1b
|
|
20
|
氣體定壓比熱容 cp����,25℃時
|
2.112kj/(kg? k)��,0.505BTU/(1b·R)
|
|
21
|
氣體定容比熱容 cp,25℃時
|
1.624kj/(kg? k)�,0.388BTU/(1b·R)
|
|
22
|
氣體比熱容比 , cp/cv
|
1.301
|
|
23
|
液體比熱容 ����,25℃時
|
4.708kj/(kg?k )����,1.125BTU/(1b·R )
|
|
24
|
因體比熱容 ,-103℃時
|
2.189kj/(kg?k )��,0.523BTU/(1b·R )
|
|
25
|
氣體摩爾熵 ��,25℃時
|
192.67j/(mol?k )
|
|
26
|
氣體摩爾生成熵�,25℃時
|
-98.94j/(mol?k )
|
|
27
|
氣體摩爾生成焓 ,25℃時
|
-45.9kj/mol
|
|
28
|
氣體摩爾吉布斯生成能 ��,25℃時
|
-16.4kj/mol
|
|
29
|
溶解度參數(shù)
|
29.217(j/cm3 )0.5
|
|
30
|
液體摩爾體積
|
24.993cm3 /mol
|
|
31
|
在水中的溶解度 ��,25 ℃時
|
全溶
|
|
32
|
辛醇 -水分配系數(shù) �����,lgKow
|
---
|
|
33
|
在水中的亨利定律常數(shù) ���,25 ℃時
|
---
|
|
34
|
氣體黏度 ��,25℃時
|
101.15×10-7Pa ?s�����,101.15μP
|
|
35
|
液體黏度 �����,25℃時
|
0.135mPa ?s�����,0.082cp
|
|
36
|
氣體熱導(dǎo)率 ��,25℃時
|
0.02466W/(m ? k)
|
|
37
|
液體熱導(dǎo)率 ����,25℃時
|
0.5024W/(m ? k)
|
|
38
|
空氣中爆炸低限含量
|
16.1%( φ )
|
|
39
|
空氣中爆炸高限含量
|
25%( φ )
|
|
40
|
閃點
|
---
|
|
41
|
自燃點
|
651.1℃,1204oF
|
|
42
|
燃燒熱 �,25℃(77oF)氣態(tài)時
|
18603.1kj/kg,7999.3BTU/1b
|
|
43
|
美國政府工業(yè)衛(wèi)生工作者會議 (ACGIH) 閾值濃度
|
25×10-6(φ )
|
|
44
|
美國職業(yè)**與衛(wèi)生管理局 (OSHA) 允許濃度值
|
50×10-6(φ )
|
|
45
|
美國國立職業(yè)**與衛(wèi)生研究所 (NIOSH) 推薦濃度值
|
25×10-6(φ )
|
化學(xué)性質(zhì)
1��、與水反應(yīng)
氨在水中的反應(yīng)可表示為:NH3+H2O=NH3·H2O
一水合氨不穩(wěn)定受熱分解生成氨和水
氨水中存在三分子�����、三離子、三平衡
分子:NH3.NH3·H2O��、H2O���;
離子:NH4+�、OH-��、H+��;
三平衡:NH3+H2O====NH3·H2O====NH4++OH- (可逆)
H2O====H++OH- (可逆)
氨水在中學(xué)化學(xué)實驗中三應(yīng)用
①用蘸有濃氨水的玻璃棒檢驗HCl等氣體的存在
②實驗室用它與鋁鹽溶液反應(yīng)制氫氧化鋁
③配制銀氨溶液檢驗有機物分子中醛基的存在�。
2���、與酸反應(yīng)
2NH3+H2SO4===(NH4)2SO4
NH3+HCl===NH4Cl
3NH3+H3PO4===(NH4)3PO4
NH3+CO2+H2O===NH4HCO3
(反應(yīng)實質(zhì)是氨分子中氮原子的孤對電子跟溶液里具有空軌道的氫離子通過配位鍵而結(jié)合成離子晶體���。若在水溶液中反應(yīng),離子方程式為:
8NH3+3Cl2===N2+6NH4Cl
(黃綠色褪去���,產(chǎn)生白煙)
反應(yīng)實質(zhì):2NH3+3Cl2===N2+6HCl
NH3+HCl===NH4Cl
總反應(yīng)式:8NH3+3Cl2===N2+6NH4Cl
3���、與氧氣反應(yīng)
4NH3+3O2==點燃==2N2+6H2O(純氧)
4���、與碳反應(yīng)
NH3+C=加熱=HCN+H2↑(劇毒氰化氫)
5、液氨的自偶電離
液氨的自偶電離為:
2NH3==(可逆)NH2- + NH4+ K=1.9×10^-30(223K)
6�、取代反應(yīng)
取代反應(yīng)的一種形式是氨分子中的氫被其他原子或基團所取代,生成一系列氨的衍生物����。另一種形式是氨以它的氨基或亞氨基取代其他化合物中的原子或基團,例如�����;
COCl2+4NH3==CO(NH2)2+2NH4Cl
HgCl2+2NH3==Hg(NH2)Cl+NH4Cl
這種反應(yīng)與水解反應(yīng)相類似�,實際上是氨參與的復(fù)分解反應(yīng),故稱為氨解反應(yīng)���。
7�、與水�、二氧化碳
NH3+H2O+CO2==NH4HCO3
該反應(yīng)是侯氏制堿法的**步,生成的碳酸氫銨與飽和氯化鈉溶液反應(yīng)生成碳酸氫鈉沉淀��,加熱碳酸氫鈉制得純堿�。
此反應(yīng)可逆,碳酸氫銨受熱會分解
NH4HCO3=(加熱)=NH3↑+CO2↑+H2O
8、與氧化物反應(yīng)
3CuO+2NH3 ==加熱==3Cu+3H2O+N2
這是一個氧化還原反應(yīng)����,也是實驗室常用的臨時制取氮氣的方法,采用氨氣與氧化銅共熱����,體現(xiàn)了氨氣的還原性。
制造方法
工業(yè)制法
工業(yè)上氨是以哈伯法通過N2和H2在高溫高壓和催化劑存在下直接化合而制成:
工業(yè)上制氨氣
高溫高壓
N2+3H2==高溫高壓催化劑===2NH3(可逆反應(yīng))
催化劑
△rHθ =-92.4kJ/mol
實驗室制備
實驗室����,氨常用銨鹽與堿作用或利用氮化物易水解的特性制備: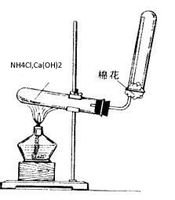 氨氣2NH4Cl(固態(tài)) + Ca(OH)2(固態(tài))===2NH3↑+ CaCl2 + 2H2O
氨氣2NH4Cl(固態(tài)) + Ca(OH)2(固態(tài))===2NH3↑+ CaCl2 + 2H2O
Li3N + 3H2O === 3LiOH + NH3↑
實驗室快速制得氨氣的方法
用濃氨水加固體NaOH(或加熱濃氨水)
氨氣檢測儀
1.泵吸式氨氣檢測儀
CY-NH3泵吸式氨氣檢測儀采用內(nèi)置吸氣泵,可快速檢測工作環(huán)境中氨氣濃度����。泵吸式氨氣檢測儀采用進口電化學(xué)傳感器�����,具有非常清晰的大液晶顯示屏����,聲光報警提示,保證在非常不利的工作環(huán)境下也可以檢測危險氣體并及時提示操作人員預(yù)防��。
2.便攜式氨氣檢測儀
HFPCY-NH3便攜式氨氣泄漏檢測儀����,可連續(xù)檢測作業(yè)環(huán)境中氨氣濃度�。氨氣檢測儀為自然擴散方式檢測氣體濃度�����,采用進口電化學(xué)傳感器���,具有極好的靈敏度和出色的重復(fù)性���;氨氣檢測儀采用嵌入式微控制技術(shù),菜單操作簡單��,功能齊全�,可靠性高,整機性能居國內(nèi)**水平�。檢測儀外殼采用高強度工程材料、復(fù)合彈性橡膠材料精制而成����,強度高、手感好���。
3.在線式氨氣報警器
HFTCY-NH3在線式氨氣檢測報警器由氣體檢測報警控制器和固定式氨氣檢測器組成����,氣體檢測報警控制器可放置于值班室內(nèi),對各監(jiān)測點進行監(jiān)測控制�����,氨氣檢測器安裝于氣體*易泄露的地點�,其核心部件為氣體傳感器。氨氣檢測器將傳感器檢測到的氨氣濃度轉(zhuǎn)換成電信號�����,通過線纜傳輸?shù)綒怏w檢測報警控制器����,氣體濃度越高,電信號越強����,當氣體濃度達到或超過報警控制器設(shè)置的報警點時���,氣體檢測報警控制器發(fā)出報警信號���,并可啟動電磁閥����、排氣扇等外聯(lián)設(shè)備���,自動排除隱患�。在線式氨氣檢測報警器廣泛應(yīng)用于石油��、化工��、冶金����、電力、煤礦����、水廠等環(huán)境,有效防止爆炸事故的發(fā)生����。
主要用途
氨用于制造氨水、氮肥(尿素����、碳銨等)�、復(fù)合肥料�����、硝酸���、銨鹽�����、純堿等����,廣泛應(yīng)用于化工���、輕工�、化肥���、制藥、合成纖維等領(lǐng)域����。含氮無機鹽及有機物中間體�����、磺胺藥����、聚氨酯�����、聚酰胺纖維和丁腈橡膠等都需直接以氨為原料����。此外,液氨常用作制冷劑���,氨還可以作為生物燃料來提供能源�����。
